刘志博,2010年本科毕业于南京大学化学化工学院化学系,2010-2014年在南京大学化学化工学院化学系攻读博士学位,期间,分别在英属哥伦比亚肿瘤中心和TRIUMF原子能国家实验室参加跨学科博士培养项目。2014-2016年在美国国立卫生研究院担任博士后研究员(导师为陈小元研究员),2016年-至今在北大-清华生命科学联合中心担任中心研究员,2016年-至今在北京大学化学与分子工程学院任特聘研究员。现还兼任昌平国家实验室领衔科学家,北京大学肿瘤医院双聘教授,北京大学应用化学系副主任等职。2022年获得国家杰出青年基金。

刘志博教授
刘教授主要从事放射性药物、中子俘获治疗和放疗响应药物研究。近年来主持国家重点研发计划、国家自然基金重点项目等多个科研项目;以通讯作者在Nature(两篇)、Nat. Chem.,Nat. Biomed.Eng.等期刊发表论文60余篇;获中国化学会青年化学奖,国际中子俘获治疗学会Fairchild Award,药明康德生命化学奖等奖项。刘志博教授团队立足自研设备实现了Ac-225、Y-86等紧缺医用核素在国内的首次制备,在国际上首次报道了核药物与核辐射响应的化疗药物,提出了靶向共价核药物的新理念,解决核药物领域长期以来靶向性不足的难题。团队开发的多个核药物分子已开展临床研究,其中硼氨酸核药物作为“一类新药”已获得中国和美国临床批件,预计于2024年底进入三期临床。在此,我们汇总了刘教授团队的代表性论文与大家一起分享,内容如下,
Nature:47年来Nature首次刊登新型放射性药物

靶向放射性核素治疗(TRT)是治疗转移性癌症的一种颠覆范式的治疗模式。TRT依赖于放射性配体或放射性药物(radioligand),其可以高亲和力与癌症相关或特异性靶点结合,并递送有效的β-颗粒或α-颗粒进行局部照射。治疗性放射性配体的成功需要良好的肿瘤靶向性、快速的血液清除和足够的肿瘤保留能力,因为大多数治疗性放射性核素的半衰期为三到十天。然而,平衡药物的血液清除率和肿瘤保留率往往是一个挑战。传统的放射性配体通常是将放射性核素标记的模块与肿瘤靶向配体连接的双功能缀合物。由于大多数配体的可逆相互作用,传统放射性配体的肿瘤保留往往不足,这损害了TRT的疗效。因此,开发以肿瘤选择性方式将放射性配体不可逆地固定到癌症靶点的平台技术,将为这个问题提供理想的解决方案。
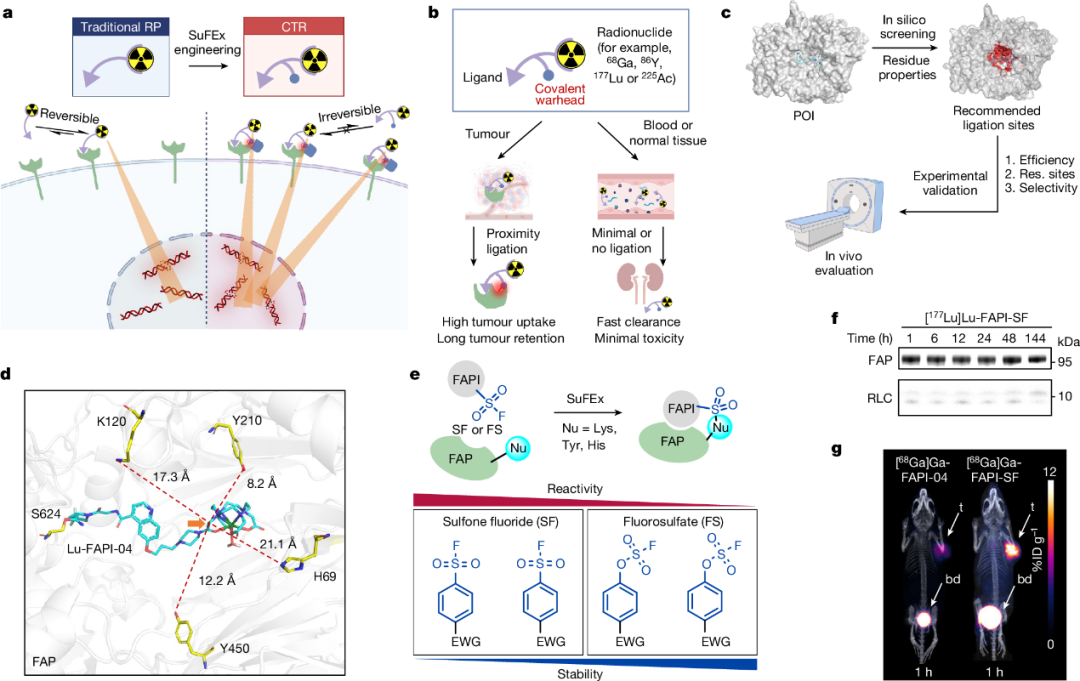
在这项研究中,北京大学刘志博教授等人在放射性药物上安装了一种基于硫(VI)氟化物交换(SuFEx)化学的接头,以防止过快的肿瘤清除。当工程化放射性药物与肿瘤特异性蛋白结合时,该系统经历结合-连接转变,并通过“点击”SuFEx反应与酪氨酸残基结合。将该策略应用于成纤维细胞活化蛋白(FAP)抑制剂(FAPI)触发了与该蛋白高达80%以上的共价结合,并且在六天内几乎没有解离。在小鼠中,SuFEx工程的FAPI显示出比原始FAPI高257%的肿瘤摄取,并将肿瘤滞留增加了13倍,同时健康组织中的摄取可被迅速清除。在一项试点成像研究中,这一策略在癌症患者中发现了比其他方法更多的肿瘤病变。此外,SuFEx工程化的FAPI也成功实现了靶向β-和α-放射性核素治疗,使小鼠的肿瘤几乎完全消退。另一种靶向前列腺特异性膜抗原(PSMA)的SuFEx工程放射性配体也显示出增强的治疗效果。考虑到可能与SuFEx弹头连接的蛋白质范围广泛,这种策略有望应用于其他癌症靶点。
https://www.nature.com/articles/s41586-024-07461-6
Nature:生物正交系统揭示焦亡的抗肿瘤免疫功能

研究细胞死亡和免疫等生物过程需要能够在活体动物中进行的生物正交化学。最近的研究已经确定了一个气孔形成蛋白的gasdermin家族,该家族执行炎症小体依赖性和非依赖性焦亡。然而,焦亡作为一种促炎性疾病,其对抗肿瘤免疫的影响尚不清楚。
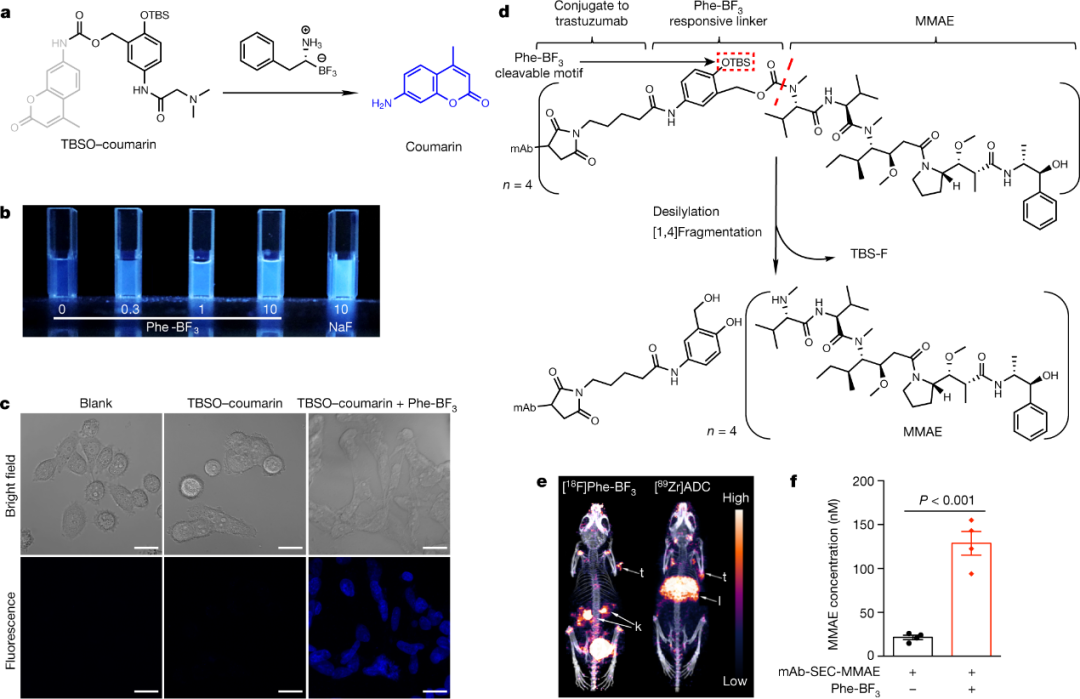
北京大学刘志博教授和北京生命科学研究所邵峰研究员等人建立了一个生物正交化学系统,其中可以进入细胞的可成像癌症探针三氟硼酸苯丙氨酸(Phe-BF3)脱硅并“切割”含有甲硅烷基醚的设计连接体。该系统能够在小鼠体内控制抗体-药物偶联物的药物释放。当与纳米颗粒介导的递送相结合时,Phe-BF3催化的脱硅作用可以从纳米颗粒缀合物中释放出一种客体蛋白,其中包括活性gasdermin,从而选择性地进入小鼠的肿瘤细胞。将这种生物正交系统应用于gasdermin,结果表明,不到15%的肿瘤细胞的焦亡足以清除整个4T1乳腺肿瘤移植物。肿瘤消退在免疫缺陷小鼠或T细胞耗竭时不存在,并且与增强的抗肿瘤免疫反应相关。注射减少的、无效剂量的纳米粒子缀合的gasdermin以及Phe-BF3使4T1肿瘤对抗PD1疗法敏感。因此,基于Phe-BF3脱硅的生物正交体系是化学生物学的有力工具;对该系统的应用表明,焦亡诱导的炎症会触发强大的抗肿瘤免疫,并与检查点阻断协同作用。
https://www.nature.com/articles/s41586-020-2079-1
Nat. Chem.:具有更加强大保护性基团的放疗活化前药

电离辐射,包括X射线和γ射线,具有组织穿透性高和散射范围小的特点。特别是现代放射治疗技术已经能够实现“三维适形”肿瘤靶向,向肿瘤提供高辐射剂量,同时对肿瘤周围的健康组织造成最小损伤。然而,由于低效率和化学选择性问题,上述策略的体内应用始终受到限制。在肿瘤放疗中,高能射线主要电离分解水产生羟基自由基(·OH)、氢自由基(H·)和水合电子(e−aq)。因此,人们根据这些电离产物开发了一些辐射可移除化学片段,并用于肿瘤中的前药激活。在这些前药激活策略中,在接受放射治疗时,可以选择性地去除保护性基团,促进药物活性的恢复。该策略旨在肿瘤内精确的药物激活,从而最大限度地减少化疗的相关副作用。然而,目前还需要开发新型放射可去除的保护基团以提高其在体内应用的效率。此外,开发不同类型的前药需要具有多样性的多功能保护基团,也就是说需要设计更多放射可移除的保护性基团。
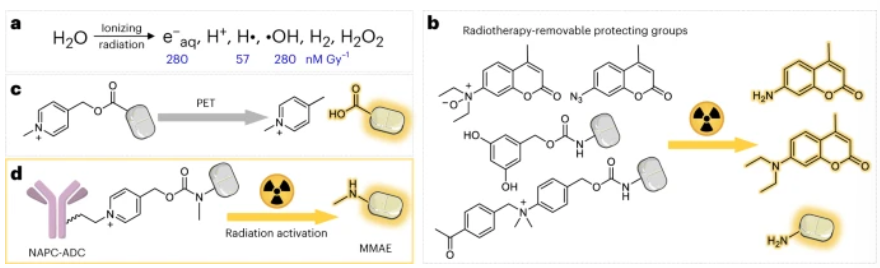
在此,北京大学刘志博研究员等人提出,公认的光诱导电子转移化学可能为开发多功能可放射去除的保护性基团铺平道路。使用功能报告分析(functional reporter assay),N-烷基-4-吡啶(NAP)被鉴定为可通过释放客体分子对辐射响应的笼化基团。当在竞争实验中进行评估时,NAP片段比迄今为止发现的其他可放射去除的保护基团更有效。利用这一特性,研究进一步开发了一种NAP衍生的氨基甲酸酯接头(linker),该接头可在辐射中释放荧光团和毒素,并可被纳入抗体-药物偶联物(ADC)中。这些设计的ADC在活细胞和荷瘤小鼠中具有活性,突出了使用这种可放射去除保护基团开发稳定性和治疗效果更好的下一代ADC的潜力。
Nat. Commun.:局部核反应可通过破坏装载免疫佐剂的硼药胶囊用于癌症免疫治疗

硼中子捕获疗法(BNCT)于2020年获得临床批准,在临床前和临床研究中表现出显著的肿瘤排斥反应。二元放射治疗可以选择性地在癌症细胞内沉积两种致命的高能粒子(4He和7Li)。作为一种由局部核反应诱导的放射治疗,很少有研究报道其远端抗肿瘤作用,这限制了其进一步的临床应用。
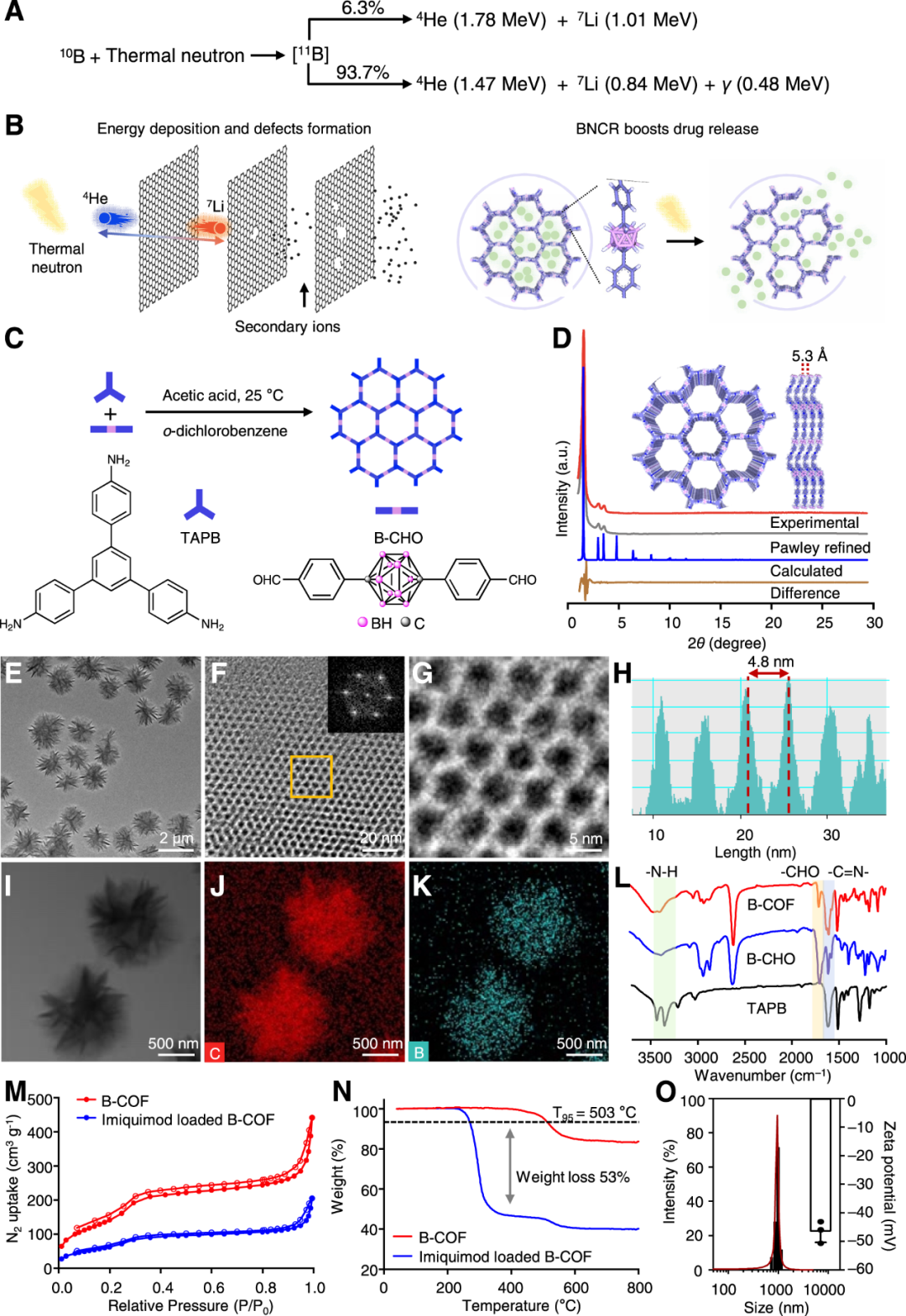
北京大学刘志博教授和浙江大学顾臻教授等人首先探索是否可以基于碳硼烷的共价有机框架(B-COF)来开发用于同时进行BNCT和免疫治疗的免疫佐剂的硼“胶囊”。当热中子被10B原子捕获时,BNCT就会发生,导致α粒子(~1.47→1.78 MeV)、反冲的7Li核(~831.6 keV→1.01 MeV)和478 keV伽马射线的发射。研究发现,中子辐照可以加速有效载荷的释放速率。中子辐照后,在硼胶囊的框架上观察到许多缺陷。此外,单细胞测序研究的结果表明,BNCT显著提高了肿瘤浸润免疫细胞的总水平,促进了免疫抑制肿瘤向免疫原性肿瘤的转化。此外,咪喹莫特的持续释放可促进巨噬细胞极化,进一步增加抗肿瘤免疫反应。这种治疗显著增加了细胞因子的分泌和功能性CD4+和CD8+T细胞的浸润,从而使“冷”肿瘤变为“热”肿瘤,因此在两种类型的携带异种移植物的小鼠中显示出对原发肿瘤和远处肿瘤的显著生长抑制。
Nat. Commun.:羧酸的光催化直接硼化反应

从廉价且丰富的羧酸制备高附加值的硼酸是人们孜孜以求的目标。迄今为止,羧酸的脱羧硼化通常通过在150°C反应温度以上的额外步骤合成氧化还原活性酯中间体或原位生成的羧酸共价衍生物来实现。受酶脱羧仿生方法的启发,科学家们一直致力于开发新的脱羧功能化策略。例如,基于聚酮的生物合成,金属/有机催化剂开发了丙二酸半硫代/氧基酯的各种脱羧反应。除了聚酮的生物合成外,尿卟啉原脱羧酶(UroD)可催化尿卟啉原脱羧,从而在植物和动物中生物合成血红素、叶绿素和细胞色素。值得注意的是,UroD可以将底物脱羧的速率提高1.2×1017倍,是一种可在没有辅因子的情况下起作用的酶。
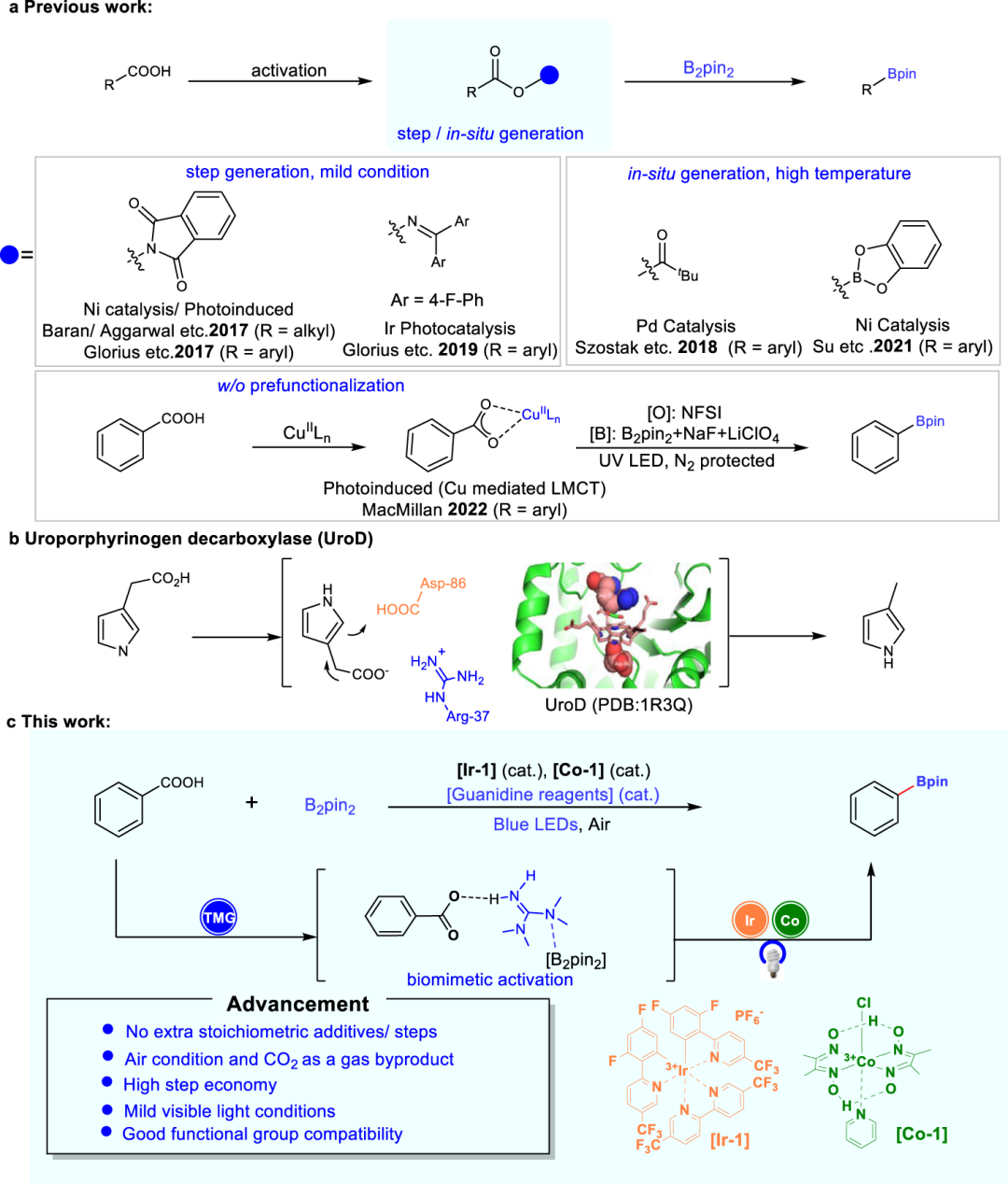
UroD的质子化碱性残基(Arg-37的胍基)被认为是通过提供抗衡离子在活性羧酸中发挥重要作用,这有助于底物的剪式羧酸基团进入相对非极性的环境,并稳定CO2离开产生的碳负离子。受此启发,北京大学刘志博教授等人报道了一种通过可见光催化实现的羧酸的直接脱羧硼化方法,该方法不需要任何额外的化学计量添加剂或合成步骤。作者引入了一种具有碱性和亲核性质的简化胍基分子,以促进直接脱羧硼化。胍可以活化苯基羧酸,同时通过平衡捕获速率和扩散速率来促进苯基羧基自由基的产生和转化。这种操作简单的过程可产生CO2,并在温和的反应条件下进行,具有高阶跃经济性和良好的官能团相容性。
Nat. Commun.:硼包被脂质体可用于联合中子俘获治疗

硼中子捕获疗法(BNCT)是一种治疗二元重粒子辐照引起的侵袭性恶性肿瘤的有吸引力的方法,但其临床应用受到体内稳定性低、生物相容性差和组合模式应用有限的硼递送剂的阻碍。
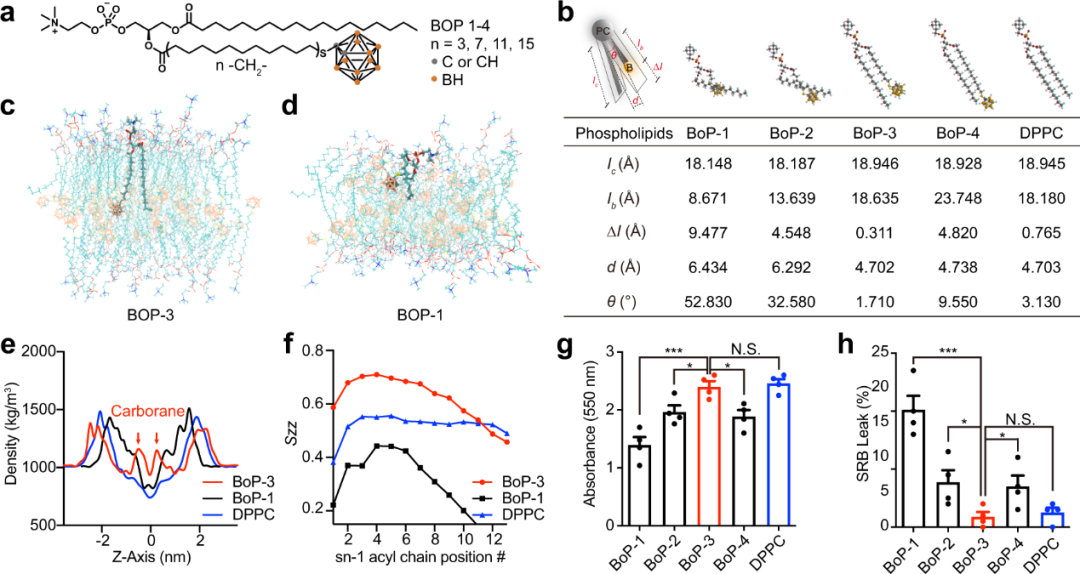
为了应对上述挑战,北京大学刘志博教授等人报道了碳硼烷衍生的脂质体类似物(boronsome,硼质体),用于成像引导化疗辅助BNCT。碳硼烷已成为医学、纳米材料和催化实践领域的明星分子。其具有的分子特性,如热稳定性和氧化还原稳定性、高疏水性和低亲核性,使碳硼烷在药物开发中具有独特优势。更不用说一个碳硼烷分子含有十个硼原子,这使得碳硼烷成为BNCT应用的完美候选者。为了开发具有高稳定性和高硼含量的生物相容性硼化脂质体,将碳芳酰基共价结合到磷脂的疏水尾部,形成一系列硼化磷脂(BoP)。作者还采用硫醇-卤代反应代替点击化学,以保持磷脂的柔韧性。此外,与之前将小分子硼物质封装在脂质体内部的工作不同,作者使用含硼部分形成脂质体膜(即硼质体),从而可释放内腔携带其他药物进行联合治疗。与其他报道的脂质体结构相比,硼组分携带更多的硼,这意味着肿瘤中的硼含量更高。正如预期的那样,与其他对照组相比,用硼组和中子辐照处理的小鼠的肿瘤生长受到显著抑制。值得注意的是,通过PARP1抑制剂封装的DNA修复系统干扰,BNCT的有效性得到了进一步放大。总之,boronsome在临床上具有作为BNCT对抗恶性肿瘤的高效和多功能递送系统的巨大潜力。
https://www.nature.com/articles/s41467-022-29780-w
JACS:放疗还原N -氧化物以在肿瘤中活化前药

以肿瘤选择性的方式精确激活化疗前药是治疗癌症而不引起全身毒性的理想方法。尽管人们已经做出了许多努力,但开发时空可控的激活方法仍然是一个尚未解决的挑战。
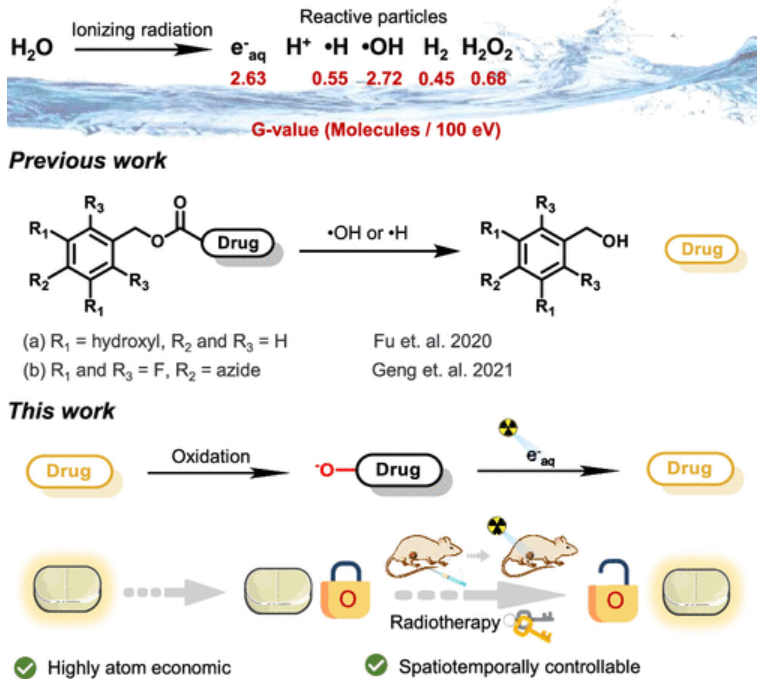
北京大学刘志博教授等人报道了一种使用放射治疗(X射线)的新型前药激活策略。由于其精确性和深层组织穿透性,X射线符合通过水辐解改变肿瘤分子的需要。研究首先证明,氮氧化物可以通过辐射产生的水合电子(e–aq)进行有效还原。作者应用该策略来激活N-氧化物前药,其中抗癌药物喜树碱(CPT)基N-氧化物前药在放射治疗激活后显示出显著的抗癌作用。由于超过50%的癌症患者接受放射治疗,这种辐射诱导的体内化学可以实现放射治疗活化前药的多功能设计,因此具有显著的临床相关性。
https://pubs.acs.org/doi/10.1021/jacs.2c02521
Angew:放射治疗诱导的季铵基裂解可激活肿瘤前药

切割(裂解)化学为以肿瘤选择性方式激活化疗前药提供了一个新的机会,然而开发具有深度组织渗透的时空可控切割化学仍然是一个巨大的挑战。从机制上讲,辐射主要通过间接效应改变生命系统中的分子,间接效应通过水辐解诱导化学反应,因为体重的70-80%是水。辐解可在10−4秒内产生各种反应性物质,如氢自由基(∙H)、羟基自由基(・OH)和水合电子(e−aq·OH)。由于在还原性生物环境(如缺氧肿瘤微环境)中,·H的产量不足或·OH的瞬间猝灭,它们在生命系统中的应用受到阻碍。值得注意的是,e−aq的产量与·OH的产量相等,并且已知在还原性环境中会增加。
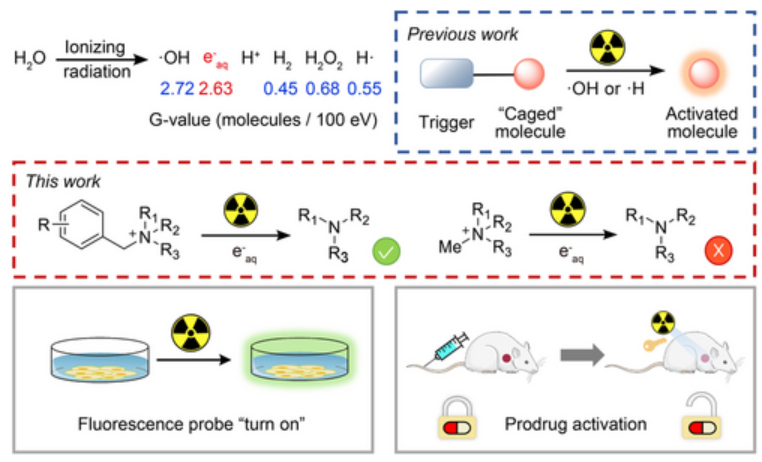
有鉴于此,北京大学刘志博教授等人开发一种由辐射诱导的e−aq介导的反应,它将在肿瘤中精确释放所需的分子。作者发现,季铵基团是一种掩蔽基团,可以通过水辐解中的水合电子(e−aq)有效去除。随后释放的叔胺可以是抗癌毒素或通过1,6-消除释放功能分子。这种放射治疗诱导的切割在活细胞和荷瘤小鼠中成功发挥作用,当给予小鼠卡非佐米前药和放射治疗时,显示出显著的治疗效果。该策略为联合放化疗提供了一个新的视角。
https://onlinelibrary.wiley.com/doi/10.1002/anie.202205014
Adv. Mater.:“AND”逻辑门控前药胶束可局部刺激抗肿瘤免疫

与传统药物相比,纳米药物具有明显的优势,特别是在癌症治疗方面,因为其循环时间延长。然而,健康组织中的脱靶药物释放缩小了治疗窗口,从而推迟了纳米药物的临床转化。因此,开发临床相关的纳米药物将需要能够以肿瘤选择性方式释放药物的先进纳米材料,这将增加最大耐受剂量并增强最小有效剂量。各种智能材料都配备了对肿瘤特异性刺激(如pH、氧化还原状态和酶)有反应的触发基团,以实现肿瘤选择性药物释放,但大多数生物标志物也在健康组织中表达。结果,单反应控制释放系统难以准确识别肿瘤细胞,导致脱靶毒性。最近创新的“与”逻辑门控系统,其释放需要两种生物标志物的存在,有望实现更高的肿瘤选择性。然而,由于需要去除两个笼化基团和生物标志物的异质性表达,增强的肿瘤靶向损害了释放效率。
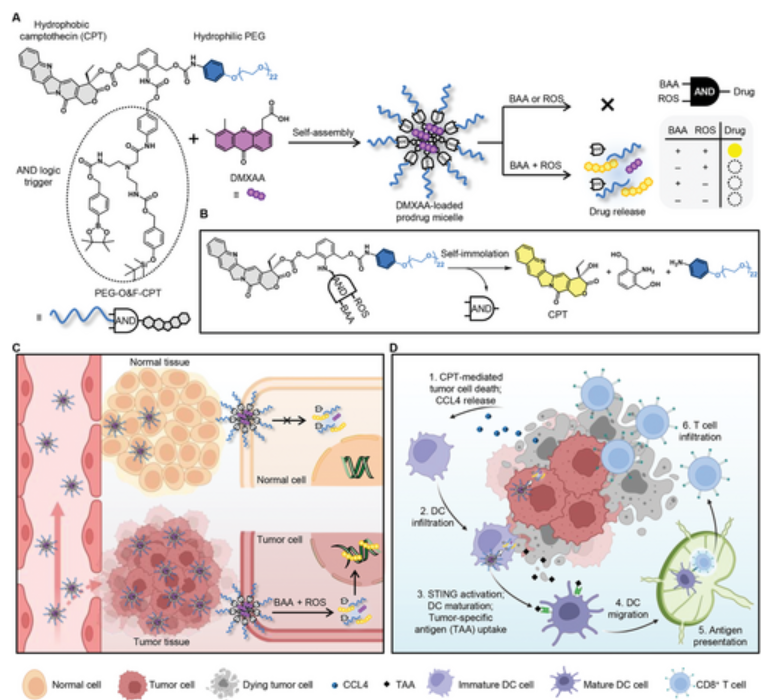
受生物正交脱硅化学显著的效率和潜在的肿瘤选择性的启发,北京大学刘志博教授等人提出了脱硅触发的与逻辑门控纳米系统,以实现高效和良好的肿瘤选择性给药。作者在先前已经报道了一种分子与(AND)逻辑门,其可促使荧光团的双重控制释放,从而提高疾病诊断的准确性。这一策略适用于各种触发因素(即氧化或脱硅),然后进行快速分子内环化以释放游离苯胺。由于对氨基苄醇是一种广泛使用的自裂解间隔物,作者设想这种AND分子逻辑触发器可以扩展到释放具有胺、羟基或羧基的功能分子,从而有助于前药设计。为此,作者通过两亲性聚合物-前药偶联物(PEG-O&F-CPT)的自组装制备了前药胶束,其包含亲水性聚乙二醇(PEG)嵌段、疏水性喜树碱(CPT)嵌段和对硼氨基酸(BAA)和活性氧(ROS)有反应的二烯基and逻辑触发器。胶束解离和药物释放通过与肿瘤代谢产生的富含肿瘤的BAA和ROS的顺序反应来进行控制。此外,PEG-O&F-CPT胶束通过π–π堆积和疏水相互作用对DMXAA(5,6-二甲基黄嘌呤-4-乙酸,一种STING激动剂)具有较高的载药能力。纳米封装促进了DMXAA在体内的肿瘤靶向递送,从而增强了免疫激活和抗肿瘤功效。
https://onlinelibrary.wiley.com/doi/10.1002/adma.202307818