日前,国际顶尖学术期刊Nature在线发表南开大学生命科学学院贡红日教授、饶子和院士与合作者的最新研究成果。该研究阐释了贝达喹啉(Bedaquiline, BDQ)及其衍生物TBAJ-587抑制结核分枝杆菌ATP合成酶的分子机理,同时揭示了它们与人源ATP合成酶间的交叉反应机制,对于开发新一代高选择性的抗结核药物具有重要指导意义。

7月8日,成果发布会在南开大学八里台校区省身楼举行。南开大学党委书记杨庆山,中国科学院院士、南开大学原校长饶子和出席发布会并讲话。中国工程院院士、广州国家实验室主任钟南山发表书面致辞。天津市第一中心医院原院长沈中阳,天津医科大学原党委书记姚智,北京胸科医院副院长、中华医学会结核病学分会前任主任委员李亮,浙江大学遗传学研究所所长、浙江大学生命科学学院原院长管敏鑫,广州国家实验室研究员毕利军以及央地主流媒体、南开大学师生代表近120人到场共同见证这一突破性科研进展。
结核病是由结核分枝杆菌引发的传染性疾病,主要侵袭肺部,严重时可导致死亡,是全球关注的重大公共卫生问题之一。贝达喹啉是一种靶向结核分枝杆菌ATP合成酶的抑制剂,可以高效地抑制结核分枝杆菌的生长,是近半个世纪以来全球结核病药物研发的第一个上市的抗结核新药,更被世界卫生组织列为耐利福平结核病和耐多药结核病长程治疗方案的首选药物。
然而,研究发现贝达喹啉由于与钾离子通道蛋白hERG相互作用导致患者心脏发生心律失常的风险增加,而且对人源ATP合成酶也存在潜在的交叉抑制活性。因此,揭示结核分枝杆菌ATP合成酶的工作机制和贝达喹啉的作用机理及其抑制人源ATP合成酶活性的分子机制,对于开发新型结核分枝杆菌ATP合成酶抑制剂具有重要意义。

研究团队首先利用“基因敲入-基因敲除-基因过表达”策略结合亲和层析及凝胶过滤层析蛋白纯化方法,最终借助耻垢分枝杆菌获得了均一稳定有活性的结核分枝杆菌ATP合成酶蛋白样品。
随后研究团队摸索优化冷冻样品制备条件,借助单颗粒冷冻电镜技术成功解析了贝达喹啉结合状态下的结核分枝杆菌ATP合成酶的高分辨率冷冻电镜结构(如图1所示)。研究发现,贝达喹啉主要通过喹啉基团(A基团)和二甲氨基基团(D基团)与结核分枝杆菌ATP合成酶强烈地相互作用并结合到跨膜区域的多个位点,阻止了ATP合成酶跨膜区域c环的旋转,从而阻断了质子的运输,最终阻止了ATP的合成,达到“饿死”结核分枝杆菌的目的。
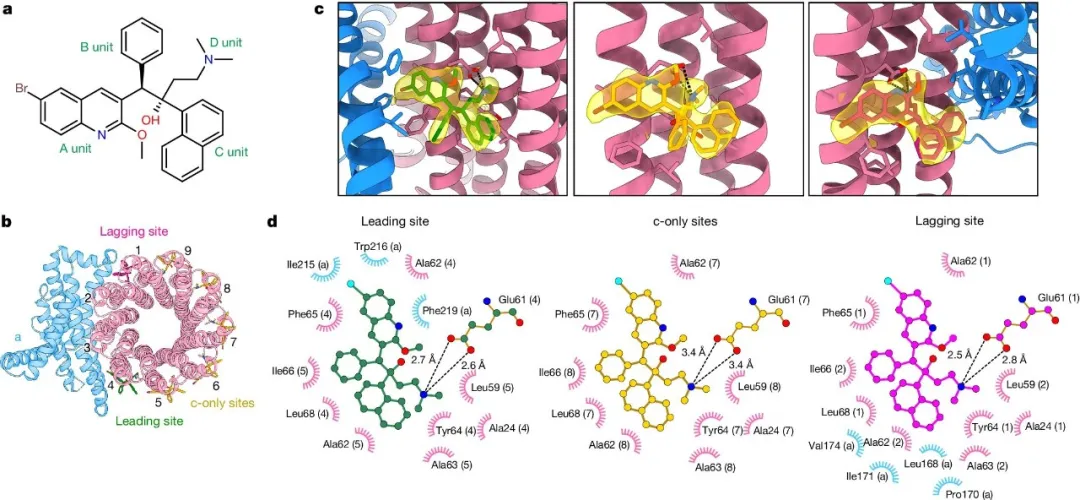
图1 结核分枝杆菌ATP合成酶结合BDQ的冷冻电镜结构
贝达喹啉衍生物中最具代表性的是TBAJ-587和TBAJ-876,目前候选药物均已进入临床实验。研究团队解析了TBAJ-587结合状态下的结核分枝杆菌ATP合成酶高分辨率冷冻电镜结构(如图2所示)。结构显示,TBAJ-587与结核分枝杆菌ATP合成酶的结合模式和贝达喹啉的结合模式相同。而且,TBAJ-587与贝达喹啉都是主要通过A基团和D基团与结核分枝杆菌ATP合成酶发生相互作用。
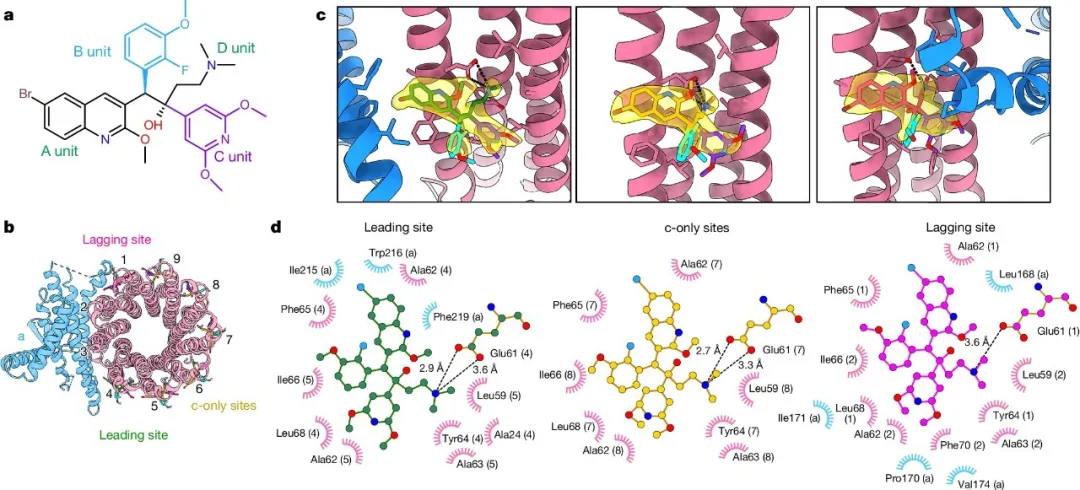
图2 结核分枝杆菌ATP合成酶结合TBAJ-587的冷冻电镜结构
最后,研究人员分析发现贝达喹啉和TBAJ-587均对人源ATP合成酶存在交叉反应。随后研究人员成功地解析了人源ATP合成酶结合贝达喹啉的冷冻电镜结构(如图3所示)。分析发现,基于BDQ中B基团和C基团再设计产生的TBAJ-587只是降低了与hERG蛋白相互作用引发心脏发生心律失常的风险,A基团再设计优化才有可能降低与人源ATP合成酶的相互作用,进而规避临床治疗中带来的潜在健康风险。
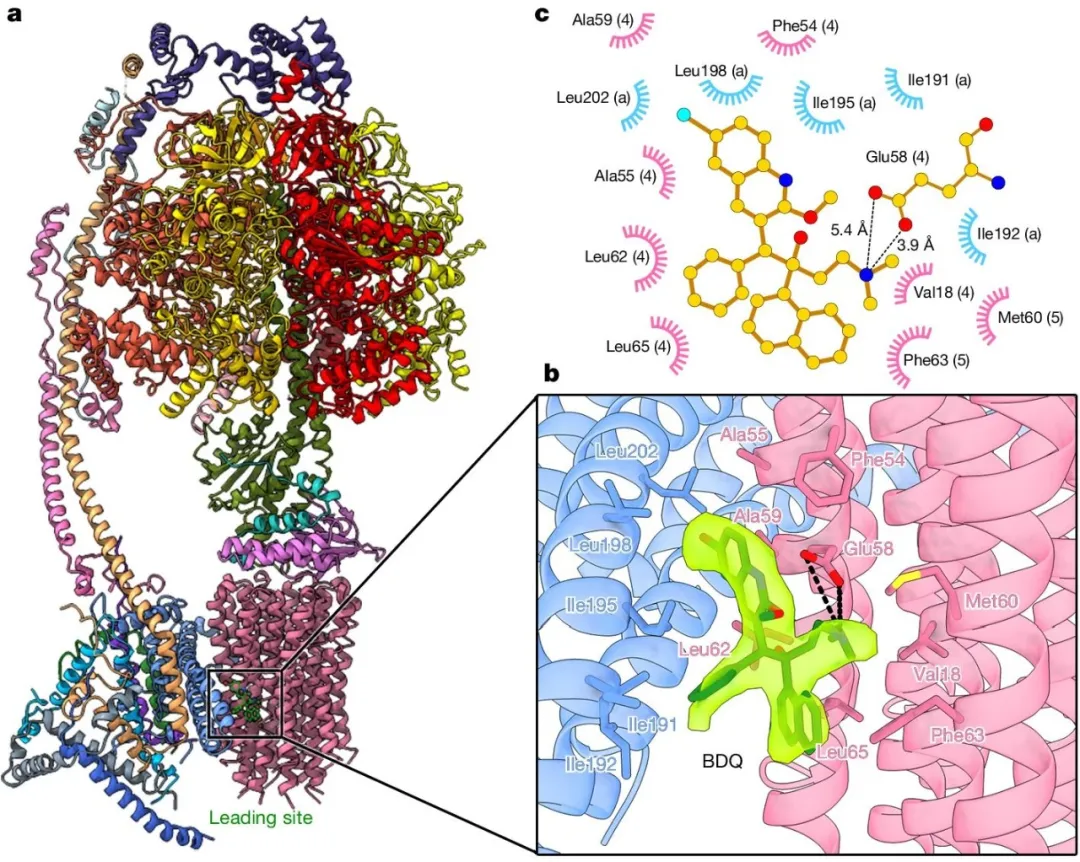
图3 人源ATP合成酶结合BDQ的冷冻电镜结构
值得一提的是,Nature同时邀请了国际学术界著名的“生物能学戈登会议”原主席格雷格·库克(Gregory Cook)教授及同事在“新闻和观点”(News & Views)专栏为本研究撰写亮点评述,题为“ATP合成机器的蓝图将有助于结核病药物的设计”(Blueprints for ATP machinery will aid tuberculosis drug design)。

贡红日教授介绍,该研究成果对于结核病基础研究和临床转化都具有重大意义,将对进一步优化贝达喹啉及开发类似甚至更为有效的新药起到推动作用。
饶子和院士表示:“我们团队长期致力于新发再发传染性疾病病原体相关蛋白质的结构与功能研究,以及创新药物的研发。我们目前已经启动开发新型结核分枝杆菌ATP合成酶抑制剂研究,争取早日研发出具有自主知识产权的抗结核新药。”

南开大学本博贯通研究生张玉莹、赖越峥为本文的共同第一作者。南开大学生命科学学院贡红日教授、饶子和院士,广州实验室刘凤江副研究员,上海科技大学免疫化学研究所高岩副研究员为共同通讯作者。南开大学为第一完成单位。

以上工作得到了国家重点研发计划青年科学家项目、国家自然科学基金优秀青年科学基金项目等项目的资助。
来源:南开大学。内容仅做学术分享之用,版权归原作者所有,若涉及侵权等行为,请联系我们删除,万分感谢!